医疗器械生产质量管理规范2015


无菌医疗器械
2.2 厂房与设施
2.2.3 植入和介入到血管内的无菌医疗器械及需要在10,000级下的局部100级洁净室(区)内进行后续加工(如灌装封等)的无菌医疗器械或单包装出厂的配件,其末道清洁处理、组装、初包装、封口的生产区域和不经清洁处理的零部件的加工生产区域应当不低于10,000级洁净度级别。
2.2.4 与血液、骨髓腔或非自然腔道直接或间接接触的无菌医疗器械或单包装出厂的配件,其末道清洁处理、组装、初包装、封口的生产区域和不经清洁处理的零部件的加工生产区域应当不低于100,000级洁净度级别。
2.2.5 与人体损伤表面和粘膜接触的无菌医疗器械或单包装出厂的配件,其末道清洁处理、组装、初包装、封口的生产区域和不经清洁处理的零部件的加工生产区域应当不低于300,000级洁净度级别。
2.2.6 与无菌医疗器械的使用表面直接接触、不需清洁处理即使用的初包装材料,其生产环境洁净度级别的设置应当遵循与产品生产环境的洁净度级别相同的原则,使初包装材料的质量满足所包装无菌医疗器械的要求;若初包装材料不与无菌医疗器械使用表面直接接触,应当在不低于300,000级洁净室(区)内生产。
2.2.7 对于有要求或采用无菌操作技术加工的无菌医疗器械(包括医用材料),应当在10,000级下的局部100级洁净室(区)内进行生产。
2.2.8 洁净工作服清洗干燥间、洁具间、专用工位器具的末道清洁处理与消毒的区域的空气洁净度级别可低于生产区一个级别,但不得低于300,000级。无菌工作服的整理、灭菌后的贮存应当在10,000级洁净室(区)内。
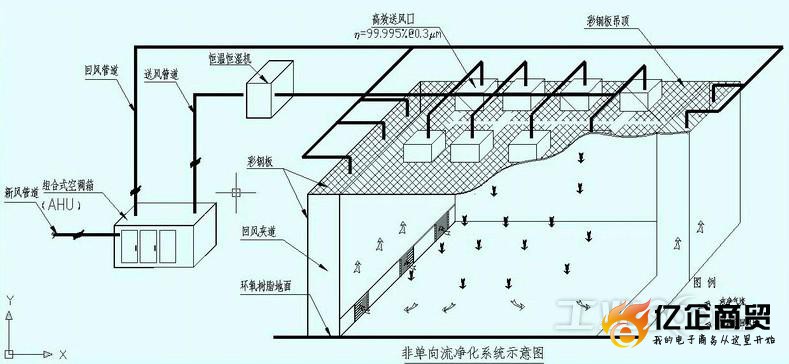

2.2.9 洁净室(区)应当按照无菌医疗器械的生产工艺流程及所要求的空气洁净度级别进行合理布局,人流、物流走向应当合理。同一洁净室(区)内或相邻洁净室(区)间的生产操作不得互相交叉污染。
2.2.10 洁净室(区)空气洁净度级别指标应当符合医疗器械相关行业标准的要求。
2.2.11 洁净室(区)的温度和相对湿度应当与产品生产工艺要求相适应。无特殊要求时,温度应当控制在18~28℃,相对湿度控制在45%~65%。
2.2.12 进入洁净室(区)的管道、进回风口布局应当合理,水、电、气输送线路与墙体接口处应当可靠密封,照明灯具不得悬吊。
●30万级~100级医疗器械净化车间、消毒用品车间设计施工;
●A~D级GMP医药工业洁净厂房设计、建造及维护保养;
●N9级~N5级微电子无尘车间、光电净化车间设计施工;
●Ⅰ~Ⅳ级SC食品工业洁净用房设计、建造;
●Ⅰ~Ⅳ级医院洁净手术部、ICU、、供应室设计、安装及维护保养;
●生物安全、动物实验室及其他行业通风净化系统设计、建造及维护保养;
江西全立森洁净技术有限公司
详情点击:http://www.quanlisen.com
项目需求登记表点击:http://www.quanlisen.com/index.aspx?lanmuid=81&sublanmuid=665






